Της Μαρίας Δήμα,
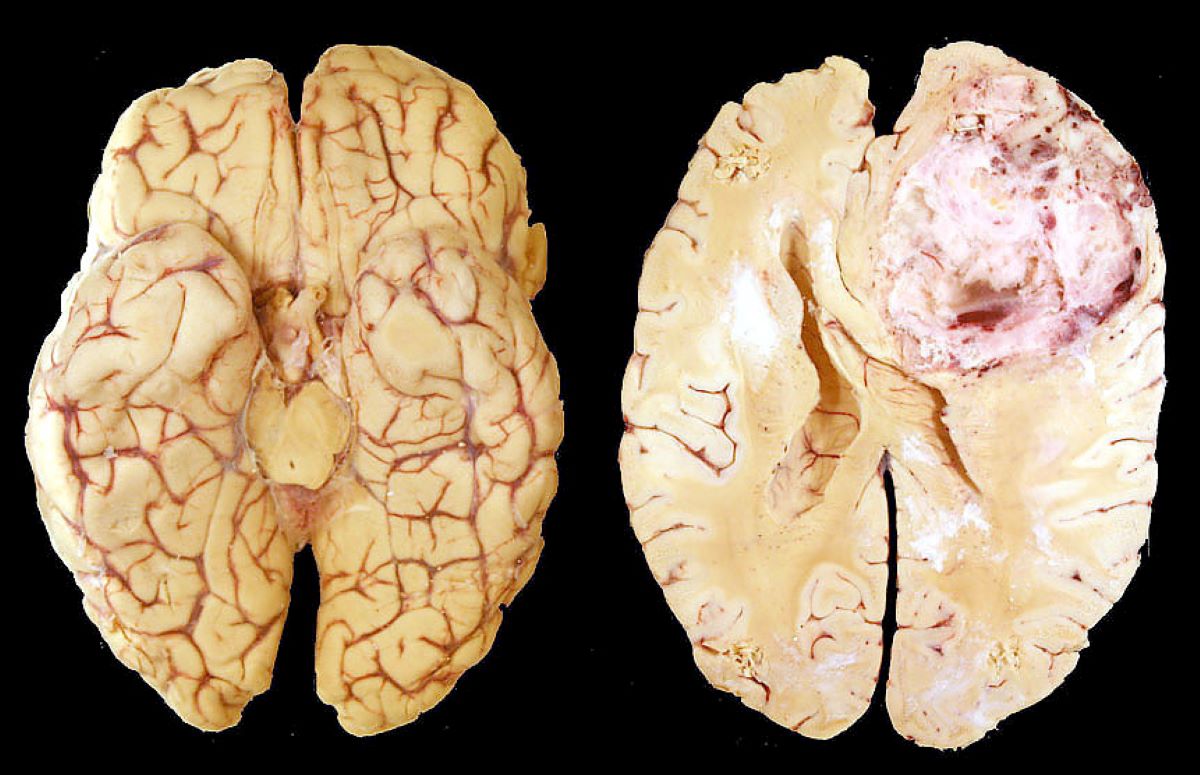
Το πολύμορφο γλοιοβλάστωμα πρόκειται για έναν από τους επιθετικότερους και πιο επικίνδυνους κακοήθεις όγκους, αντιπροσωπεύοντας το 45,2% των κακοήθων όγκων του εγκεφάλου και του κεντρικού νευρικού συστήματος. Η μέση ηλικία εμφάνισης είναι τα 64 έτη, ενώ η πρόγνωση των ασθενών είναι δυσμενής, με μέσο όρο επιβίωσης τους 15 μήνες. Το θεραπευτικό πλάνο για την εν λόγω νόσο είναι συνήθως περίπλοκο, καθώς απαιτεί τη συνεργασία εξειδικευμένων και έμπειρων χειρουργών, ακτινολόγων και ογκολόγων.
Ο όγκος αυτός εμφανίζεται είτε πρωτοπαθώς (de novo) είτε δευτεροπαθώς από ένα χαμηλού βαθμού γλοίωμα (grade 2 ή 3). Προέρχεται από ειδικά στηρικτικά κύτταρα του εγκεφάλου μας, τα οποία ονομάζονται γλοιακά. Στην πλειονότητα των περιπτώσεων εμφανίζεται στα εγκεφαλικά ημισφαίρια, αλλά έχουν παρατηρηθεί και ασθενείς στους οποίους ο όγκος είχε επεκταθεί στις μήνιγγες και στις κοιλίες του εγκεφάλου. Η μετάσταση στον νωτιαίο μυελό μέσω του εγκεφαλονωτιαίου υγρού εμφανίζεται ιδιαίτερα σπάνια. Παράλληλα, είναι δυνατή η μετανάστευση των κακοήθων κυττάρων από το ένα ημισφαίριο στο άλλο, μέσω ειδικών συνδετικών ινών, όπως το μεσολόβιο. Αυτή η επέκταση συχνά δίνει στον όγκο μια χαρακτηριστική μορφολογία που μοιάζει με πεταλούδα, όταν απεικονίζεται σε τομογραφία (butterfly glioma). Με βάση την ομοιότητα των κακοήθων κυττάρων με τα φυσιολογικά, οι όγκοι βαθμολογούνται ως Grade 1, 2, 3 και 4. Οι grade 1 όγκοι είναι καλά διαφοροποιημένοι, οπότε έχουν χαμηλό βαθμό κακοήθειας. Το πολύμορφο γλοιοβλάστωμα, αρχικά, ταξινομήθηκε ως αστροκύτωμα Grade 4, είτε με μεταλλάξεις στο γονίδιο της ισοκιτρικής αφυδρογονάσης (IDH) είτε χωρίς. Ωστόσο, σύμφωνα με τις νεότερες κατευθυντήριες οδηγίες του Παγκόσμιου Οργανισμού Υγείας (WHO), το πολύμορφο γλοιοβλάστωμα επαναταξινομήθηκε ως Grade 4 IDH-wildtype αστροκύτωμα, δηλαδή χωρίς μεταλλάξεις στο γονίδιο IDH, το οποίο πλέον αποτελεί βασικό κριτήριο για τη διάγνωση.

Στην πλειονότητα των περιπτώσεων, η εμφάνιση του όγκου γίνεται τυχαία, μέσω μεταλλάξεων που συσσωρεύονται κατά τη διάρκεια της ζωής του ατόμου. Ορισμένα γενετικά σύνδρομα, όπως η νευροϊνωμάτωση τύπου 1, το σύνδρομο Li-Fraumeni, το σύνδρομο Lynch και το σύνδρομο Turcot, αυξάνουν τον κίνδυνο εμφάνισης του γλοιοβλαστώματος. Επιπλέον, έχει παρατηρηθεί αυξημένος κίνδυνος εμφάνισης του όγκου σε άτομα που έχουν υποβληθεί σε προηγούμενη ακτινοβόληση στην περιοχή του κεφαλιού.
Πρώιμα συμπτώματα της νόσου αποτελούν οι πονοκέφαλοι, ναυτία, εμετοί και επιληπτικές κρίσεις. Ταυτόχρονα, μπορεί να παρατηρηθούν προβλήματα μνήμης, όρασης, λόγου και ακοής, ανάλογα με την προσβεβλημένη περιοχή. Παθοφυσιολογικά, τα κύτταρα εμφανίζουν διάφορες μεταλλάξεις, μέσω των οποίων γίνεται η εξαλλαγή τους σε κακοήθη κύτταρα. Με τον τρόπο αυτόν διαφεύγουν από τους συνήθεις μηχανισμούς επιτήρησης του οργανισμού μας και πολλαπλασιάζονται ραγδαία, αυξάνοντας τον όγκο σε μέγεθος και δημιουργώντας νέες περιοχές αγγειογένεσης, έτσι ώστε να προσλαμβάνουν τα καρκινικά κύτταρα θρεπτικά συστατικά και οξυγόνο. Καθώς ο όγκος μεγαλώνει, αυξάνεται η ενδοκράνια πίεση, ενώ πιέζονται και λειτουργικά σημαντικές περιοχές του εγκεφάλου, γεγονός που ερμηνεύει τα προαναφερθέντα κλινικά συμπτώματα.

Αναφορικά με τη μοριακή και γενετική βάση του όγκου, έχουν ταυτοποιηθεί ποικίλες μεταλλάξεις. Στο πολύμορφο γλοιοβλάστωμα, το γονίδιο της ισοκιτρικής αφυδρογονάσης (IDH) είναι φυσικού τύπου, δηλαδή δεν παρουσιάζει μεταλλάξεις. Επιπλέον, παρατηρούνται μεταλλάξεις στα ογκοκατασταλτικά γονίδια TP53 και PTEN (το πρώτο είναι γνωστό και ως το γονίδιο «φρουρός» των κυττάρων), παρουσία μετάλλαξης του προαγωγέα TERT, καθώς και ενίσχυση του γονιδίου EGFR, με ταυτόχρονες προσθήκες στο χρωμόσωμα 7 και απαλοιφές από το χρωμόσωμα 10. Όλες αυτές οι αλλαγές προκαλούν υπερενεργοποίηση των μονοπατιών κυτταρικού πολλαπλασιασμού, όπως το PI3K/PDK/AKT/mTOR και το Ras/Raf/MEK/MAPK, με αποτέλεσμα να προκαλείται αυξημένος κυτταρικός πολλαπλασιασμός των κακοήθων κυττάρων. Οι πυκνές συναθροίσεις κυτταροτοξικών Τ κυττάρων μπορεί να σχετίζονται με μεγαλύτερη επιβίωση, ενώ οι όγκοι με τη σύντηξη FGFR3::TACC3 μπορεί να σχετίζονται με καλύτερη εξέλιξη και να αποτελούν στόχο θεραπείας. Είναι, επίσης, αξιοσημείωτο ότι η μεθυλίωση στον προαγωγέα MGMT (πρωτεΐνη που φυσιολογικά προστατεύει το γονιδίωμα μας από τη μεθυλίωση των βάσεων στο DNA), η οποία παρατηρείται στους μισούς περίπου ασθενείς, σχετίζεται με καλύτερη πρόγνωση.

Η διάγνωση του όγκου γίνεται μέσω αξονικής ή μαγνητικής τομογραφίας ή μέσω καθοδηγούμενης βιοψίας από τον εγκέφαλο, μέσω της οποίας ταυτοποιούνται ανοσοϊστοχημικά οι ειδικοί μοριακοί δείκτες του συγκεκριμένου όγκου.
Θεραπευτικά, μπορεί να διενεργηθεί χειρουργική εκτομή του όγκου, η οποία είναι μια εξαιρετικά δύσκολη διαδικασία, τόσο λόγω της εντόπισης του όγκου όσο και λόγω της διασποράς του σε σημεία που δεν είναι εμφανή μέσω της MRI. Παράλληλα, ακολουθείται ακτινοθεραπεία και χημειοθεραπεία καθημερινά για 6 εβδομάδες και έπειτα, ένα εξάμηνο σχήμα με χημειοθεραπεία χορηγούμενη 5 φορές τον μήνα. Η πιο συνήθης χημειοθεραπευτική προσέγγιση είναι η τεμοζολομίδη. Μετά την πρόσληψη, μετατρέπεται ενζυμικά στον ενεργό μεταβολίτη MTIC, ο οποίος δρα ως αλκυλιών παράγοντας προάγοντας τη μεθυλίωση γουανυλικών βάσεων στο DNA. Επιπλέον, για να μειωθεί το περιοχικό οίδημα γύρω από τον όγκο και για να βελτιωθεί η κεφαλαλγία και οι ναυτίες, χορηγείται σε μεγάλες δόσεις δεξαμεθαζόνη, ένα αντιφλεγμονώδες φάρμακο που δρα σαν την κορτιζόνη, αλλά χωρίς να παρουσιάζει αλατοκορτικοειδή δράση. Για τον περιορισμό των επιληπτικών κρίσεων, χορηγούνται αντιεπιληπτικά, όπως η λεβετιρακετάμη. Ακόμα, είναι δυνατή η εφαρμογή βραχυθεραπείας, στην οποία η πηγή ακτινοβόλησης, κατά τη διάρκεια της ακτινοθεραπείας, τοποθετείται απευθείας μέσα ή δίπλα στον όγκο, καθιστώντας δυνατή την εφαρμογή μεγαλύτερης δόσης από ό,τι θα γινόταν με τις κλασικές μεθόδους ακτινοβόλησης. Μια σχετικά νέα, μη επεμβατική μέθοδος είναι τα TT ή TT Fields (Πεδία Θεραπείας Όγκων). Η μέθοδος αυτή χρησιμοποιεί εναλλασσόμενα ηλεκτρικά πεδία, τα οποία εφαρμόζονται στο τριχωτό της κεφαλής, με σκοπό να αναστείλουν την ανάπτυξη των καρκινικών κυττάρων ή να προκαλέσουν τον θάνατό τους.
Δεδομένου, όμως, ότι στον συγκεκριμένο καρκίνο η πενταετής πρόγνωση καθορίζεται στο 5%, τι είναι αυτό που καθιστά τον όγκο αυτόν τόσο επιθετικό; Η απάντηση έγκειται στο ότι το πολύμορφο γλοιοβλάστωμα έχει αναπτύξει διάφορους μηχανισμούς καταστολής του ανοσοποιητικού μας συστήματος όχι μόνο στο σημείο εμφάνισης του όγκου, αλλά σε ολόκληρο τον οργανισμό. Για να κατανοήσουμε αυτούς τους μηχανισμούς, πρέπει πρώτα να μελετήσουμε τους φυσιολογικούς μηχανισμούς ανοσίας. Υπάρχουν δύο τύποι ανοσίας, η εγγενής (φυσική) και η επίκτητη. Η φυσική ανοσία είναι γενετικά προκαθορισμένη και αποτελεί την πρώτη γραμμή άμυνας του οργανισμού. Εδώ επικρατούν τα δενδριτικά κύτταρα, τα κοκκιοκύτταρα, τα μαστοκύτταρα και τα κύτταρα φυσικοί φονείς (Nk cells). Η επίκτητη ανοσία αναπτύσσεται κατά τη διάρκεια της ζωής μας μέσω της έκθεσής μας σε διάφορα αντιγόνα και σε αυτήν πρωτεύοντα ρόλο κατέχουν τα Β λεμφοκύτταρα, τα οποία παράγουν αντισώματα έναντι των βλαπτικών παραγόντων, και τα Τ λεμφοκύτταρα, τα οποία είτε παρουσιάζουν κυτταροτοξικές ιδιότητες (T cytotoxic cells) είτε βοηθούν στη διαδικασία της αντιγονοπαρουσίασης και της ενεργοποίησης των Τ κυτταροτοξικών κυττάρων (T helper cells). Τα κακοήθη κύτταρα στο πολύμορφο γλοιοβλάστωμα απενεργοποιούν σημεία ελέγχου (checkpoints) του ανοσοποιητικού συστήματος στα Τ κύτταρα, που τα αποτρέπουν να τα αναγνωρίσουν και, επομένως, να τα καταστρέψουν. Ένα τέτοιο παράδειγμα αποτελεί η έκφραση του δείκτη PD-L1 στα κύτταρα του όγκου, το οποίο συνδέεται με τον υποδοχέα PD-1 των Τ κυττάρων, αναστέλλοντας τη φυσιολογική τους λειτουργία.
Άλλοι παράγοντες που συνεισφέρουν στην επιθετικότητα του όγκου είναι ο χρόνος διπλασιασμού του, καθώς είναι δυνατόν να διπλασιαστεί σε μέγεθος μέσα σε διάστημα 7 μηνών, αλλά και η έντονη αγγειογένεση, η οποία συμβάλλει στην ταχεία μεταφορά του όγκου σε άλλα σημεία του εγκεφάλου. Παράλληλα, τα κύτταρα του όγκου είναι ικανά να δώσουν γένεση σε καρκινικά βλαστικά κύτταρα, τα οποία συμβάλλουν στη δημιουργία νέων αγγείων. Τέλος, παρά τις ποικίλες χημειοθεραπευτικές προσεγγίσεις μέσω της αναστολής διαφόρων κυτταρικών μονοπατιών, τα κύτταρα έχουν αναπτύξει μηχανισμούς επιβίωσης μέσω της ενεργοποίησης παράπλευρων μονοπατιών. Για αυτόν τον λόγο ενδείκνυται και η χορήγηση ανοσοθεραπείας.

Προς το παρόν, τα κύτταρα του όγκου είναι ανθεκτικά στις μεθόδους θεραπείας. Νέες έρευνες διεξάγονται διαρκώς για την ανεύρεση νέων, αποτελεσματικών θεραπευτικών μεθόδων. Οι τρέχουσες θεραπείες επικεντρώνονται, κυρίως, στην ανακούφιση των συμπτωμάτων και στη βελτίωση της ποιότητας ζωής των ασθενών, καθώς οι αποτελεσματικές θεραπείες για την οριστική αντιμετώπιση του γλοιοβλαστώματος εξακολουθούν να είναι περιορισμένες.
ΕΝΔΕΙΚΤΙΚΕΣ ΠΗΓΕΣ
- Glioblastoma, διαθέσιμο εδώ
- Glioblastoma Multiforme (GBM): Advancing Treatment for a Dangerous Brain Tumor, διαθέσιμο εδώ
- Some Facts About Glioblastoma Multiforme, διαθέσιμο εδώ
- Glioblastoma Multiforme, διαθέσιμο εδώ
- A History of the Classification of Glioma Brain Tumors, διαθέσιμο εδώ