Του Εμμανουήλ Μπιμπή,
Η αρχική αντίληψη πως τα βακτήρια ζουν ως μεμονωμένα κύτταρα, αυτό-ρυθμίζοντας όλες τις λειτουργίες τους, έχει καταρριφθεί τα τελευταία πενήντα χρόνια. Σήμερα, τα βακτήρια πιστεύεται πως βρίσκονται σε συνεχή επικοινωνία όχι μόνο με το φυσικό τους περιβάλλον, αλλά και με τα υπόλοιπα κύτταρα του πληθυσμού. Το Quorum Sensing αποτελεί έναν τέτοιο μηχανισμό επικοινωνίας μεταξύ των κυττάρων, στον οποίο τα κύτταρα εκκρίνουν κατάλληλα μόρια και διαθέτουν υποδοχείς, για να ανιχνεύουν τα αντίστοιχα μόρια που προέρχονται από τα άλλα κύτταρα.
Αυτός ο μηχανισμός δίνει τη δυνατότητα στα βακτήρια να ελέγχουν την ενεργοποίηση συγκεκριμένων γονιδίων, που καθορίζουν ενεργοβόρα φαινοτυπικά χαρακτηριστικά βάσει το μέγεθος του πληθυσμού τους που υπολογίζεται με βάση τη συγκέντρωση του σηματοδοτικού μορίου στο περιβάλλον τους. Μηχανισμοί που ελέγχονται από το quorum sensing περιλαμβάνουν την απόκτηση θρεπτικών από το περιβάλλον, την παραγωγή τοξινών και άλλων μορίων που θα βοηθήσουν στη μολυσματικότητα των βακτηρίων, την έκκριση παραγόντων που θα καταστέλλουν το ανοσοποιητικό σύστημα, αλλά και τον σχηματισμό των βιουμενίων (biofilms). Ιδιαίτερα ενδιαφέρουσα είναι η συμβολή του στη βιοφωταύγια, καθώς εκεί μελετήθηκε αρχικά.
Στην πράξη, όταν ο πληθυσμός των βακτηρίων είναι μικρός, υπάρχει μια χαμηλή παραγωγή του σηματοδοτικού μορίου που δεν μπορεί να επάγει την έκφραση συγκεκριμένων γονιδίων. Καθώς αυξάνεται ο αριθμός των κυττάρων, αυξάνεται και η ποσότητα του σηματοδοτικού μορίου στο περιβάλλον και μόλις ξεπεραστεί ένα κατώφλι, το ίδιο το σηματοδοτικό μόριο επάγει μεγαλύτερη έκφραση του εαυτού του, για να οδηγήσει μετά στην ενεργοποίηση των υπόλοιπων γονιδίων.
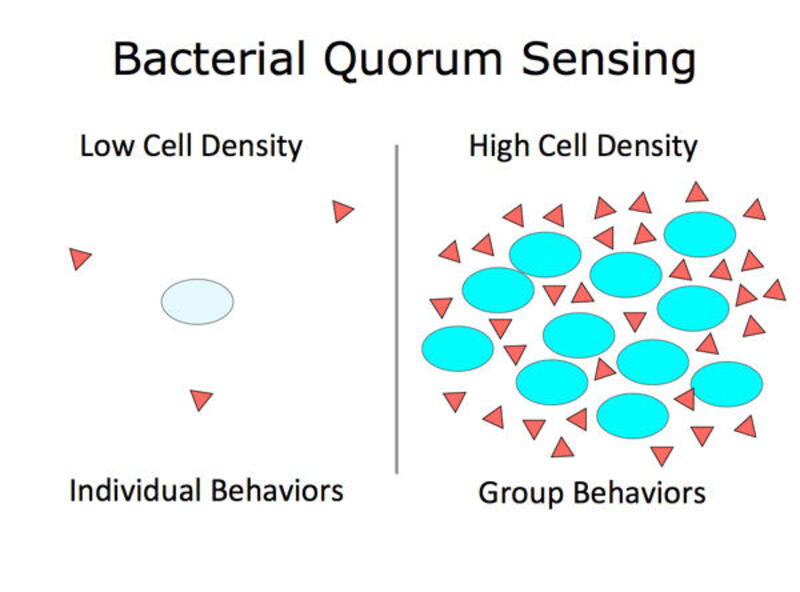
Ανάμεσα στους διάφορους μοριακούς μηχανισμούς που έχουν μελετηθεί, υπάρχουν οι εξής τρείς. Ο πρώτος περιλαμβάνει ως σηματοδοτικό μόριο το AHL (N-acyl-homoserine lactone) και έχει παρατηρηθεί στα κατά gram αρνητικά βακτήρια. Συγκεκριμένα, υπάρχει μια πρωτεΐνη η οποία θα παράγει το συγκεκριμένο μόριο και μια που θα το αναγνωρίσει, για να επάγει την έκφραση των γονιδίων. Η πρωτεΐνη αυτή λειτουργεί σαν κυτταροπλασματικός υποδοχέας που μόλις συνδεθεί με το μόριο αλλάζει τη στερεοδιάταξή του, για να επάγει τη μεταγραφή των γονιδίων. Ο μηχανισμός αυτός χρησιμοποιείται στην παραγωγή βιοφωταύγιας στο βακτήριο Aliivibrio fiscberi.
Ο δεύτερος μηχανισμός συναντάται στα κατά gram θετικά βακτήρια και σε αντίθεση με τον προηγούμενο μηχανισμό, το σηματοδοτικό μόριο είναι εκκρινόμενα πεπτίδια που ονομάζονται AIP (Autoinducing peptides). Τα πεπτίδια αυτά παράγονται, αρχικά, ως πρόδρομα μόρια από τα ριβοσώματα των κυττάρων, έπειτα τροποποιούνται και, τέλος, μεταφέρονται έξω από το κύτταρο. Η αντίληψη των πεπτιδίων από τα υπόλοιπα κύτταρα γίνεται με μεμβρανικούς υποδοχείς με λειτουργία κινάσης. Μόλις συνδεθεί το πεπτίδιο, επάγεται η φωσφορυλίωση σε έναν δεύτερο κυτταροπλασματικό ρυθμιστικό παράγοντα που με τη σειρά του θα ενεργοποιηθεί, για να επάγει την έκφραση των κατάλληλων γονιδίων.
Ο τρίτος μηχανισμός είναι σημαντικός για την παραγωγή βιοφωταύγιας στο βακτήριο Vibrio barveyi και για τον σχηματισμό βιουμενίων σε διάφορα βακτήρια. Αυτός ο μηχανισμός υπάρχει τόσο σε κατά gram αρνητικά όσο και σε κατά gram θετικά βακτήρια. Το σηματοδοτικό μόριο σε αυτή την περίπτωση είναι το AI-2 που στην πράξη είναι μια οικογένεια μορίων που προκύπτουν από το DPD (4,5-διύδρο-2,3-πενταδιόνη).
Η ανακάλυψη πως σε αρκετά παθογόνα μικρόβια που προσβάλουν φυτικούς, ζωικούς οργανισμούς, αλλά και τον άνθρωπο, υπάρχουν χαρακτηριστικά που ελέγχονται από το quorum sensing, οδήγησε τους επιστήμονες στο να ελέγξουν κατά πόσο η ίδια η παθογονικότητά τους ρυθμίζεται με αντίστοιχο τρόπο.
Αρχικά, το κατά gram αρνητικό Pseudomonas aeruginosa, το οποίο αποτελεί ένα ευκαιριακό παθογόνο, διαθέτει διαφορετικά στελέχη του προσβάλλουν φυτά και ζώα και στον άνθρωπο μεταξύ άλλων προκαλεί χρόνιες μολύνσεις σε πληγές και προσβάλλει τους πνεύμονες ασθενών με κυστική ίνωση. Οι επιστήμονες παρατήρησαν πως οι εξωκυττάριοι παράγοντες που παράγει το βακτήριο για να εισβάλλει και να διαδοθεί στο εσωτερικό του ασθενή, όπως πρωτεάσες, ελέγχονται από δυο AHL συστήματα, τα LasR-LasI και RhlR-RhlI με το πρώτο να ρυθμίζει την ενεργοποίηση του δεύτερου.
Η απόδειξη της συμμετοχής των παραπάνω συστημάτων στη ρύθμιση γονιδίων που ελέγχουν την παθογονικότητα πραγματοποιήθηκε με τη χρήση μεταλλαγμένων στελεχών, που τους έλειπε ο υποδοχέας LasR. Οι ερευνητές χρησιμοποίησαν in vivo μοντέλα ποντικών, αλλά και εντόμων ή φυτών και έλεγξαν την ικανότητα των κυττάρων να προκαλούν οξεία πνευμονία, προσκόλληση στα επιθηλιακά κύτταρα της αναπνευστικής οδού, βακτηριαιμία και θάνατο. Πράγματι, τα μεταλλαγμένα στελέχη σε σχέση με τα αγρίου τύπου, δεν μπορούσαν να προσβάλλουν τα ποντίκια και να προκαλέσουν ασθένεια. Αντίστοιχες μελέτες έγιναν και με μεταλλαγμένα στελέχη ως προς τη συνθάση που παράγει το σηματοδοτικό μόριο και παρατήρησαν ανάλογα αποτελέσματα.
Η μελέτη του φαινομένου στα κατά gram θετικά βακτήρια είναι εστιασμένη γύρω από το Staphylococcus aureus, ο οποίος αποτελεί έναν κοινό συμβιώτη του φάρυγγα με το 30% των ανθρώπων να φέρουν το βακτήριο ανά πάσα στιγμή. Ωστόσο, είναι υπεύθυνο για τόσο χρόνιες όσο και οξείες μολύνσεις ενώ παράγει διάφορους παράγοντες όπως τοξίνες που ενισχύουν την μολυσματικότητα του και το βοηθούν να ξεπεράσει τους μηχανισμούς του ανοσοποιητικού συστήματος. Η έκκρισή τους ελέγχεται από τέσσερεις τάξεις πεπτιδίων τύπου AIP τα οποία συμμετέχουν σε ειδοειδικές και διαειδικές επικοινωνίες αλλά σε ανταγωνισμό μεταξύ στελεχών.
Σε μοριακό επίπεδο, υπάρχει το ARG οπερόνιο που περιέχει τα argBDCA γονίδια. Οπερόνιο αποτελεί ένα σύνολο γονιδίων των οποίων η μεταγραφή ελέγχεται από ένα κοινό υποκινητή, ενώ τα γονίδια αυτά συμμετέχουν στο ίδιο βιοχημικό μονοπάτι. Το argD είναι υπεύθυνο για την παραγωγή του πρόδρομου μορίου του AIP, το argB για την ωρίμανση και μεταφορά έξω από το κύτταρο του AIP, ενώ το argC αποτελεί τον υποδοχέα με λειτουργία κινάσης και το argA αποτελεί τον μεταγραφικό παράγοντα που ελέγχει την έκφραση των παραπάνω γονιδίων, αλλά και αυτών που θα προάγουν την παθογονικότητα.
Ενδιαφέρον προκαλεί το γεγονός ότι σε διαφορετικά σημεία κατά τη διάρκεια της μόλυνσης, τα διαφορετικά επίπεδα έκφρασης των arg γονιδίων οδηγούν σε παραγωγή άλλων παραγόντων. Αρχικά τα χαμηλά επίπεδα οδηγούν σε παραγωγή πρωτεϊνών προσκόλλησης, ενώ αργότερα αυξάνονται τα επίπεδα έκφρασης, οδηγώντας σε παραγωγή πρωτεϊνών που προκαλούν βλάβες στους ιστούς και που βοηθούν στην απόδραση από το εσωτερικό των φαγοκυττάρων πριν τη λύση τους. Με αυτόν τον τρόπο τους δίνεται η δυνατότητα να εισέλθουν στην κυκλοφορία του αίματος και να διασπαρθούν σε άλλα σημεία στο σώμα.
Εκτός από τις συστημικές μολύνσεις, το quorum sensing ελέγχει τον σχηματισμό και των biofilms σε ενδονοσοκομειακές μολύνσεις και μολύνσεις που σχετίζονται με προσθετικά μέλη. Συγκεκριμένα, σε μεταλλάξεις του οπερονίου arg, τα κύτταρα φαίνεται πως φτιάχνουν πιο πυκνά και ανθεκτικά biofilms, ενώ εμποδίζεται η αποκόλληση των κυττάρων και η μετάβαση σε συστημική μόλυνση. Σημαντική παρατήρηση αποτελεί η ικανότητα του ξενιστή να εμποδίζει το σύστημα αυτό με την παραγωγή ενεργών οξειδωτικών μορίων τα οποία απενεργοποιούν τα AIP σηματοδοτικά μόρια.
Συνοψίζοντας, παρά τις παραπάνω ενδείξεις για τη σημαντική συμμετοχή του quorum sensing ως μέσο επικοινωνίας των βακτηρίων για τον έλεγχο της έκφρασης πολλών γονιδίων, η πλήρης συμμετοχή τους κατά τη διάρκεια των μολύνσεων περιορίζεται από προφανείς λόγους απόκτησης και χρήσης ανθρώπινων δειγμάτων στις μελέτες. Παρόλα αυτά, πρόοδος έχει φανεί στη μελέτη ασθενών με κυστική ίνωση και προσβεβλημένους με Pseudomonas aeruginosa, με έμφαση στον εντοπισμό των σηματοδοτικών μορίων, τον χαρακτηρισμό λειτουργικού quorum sensing σε χρόνιες μολύνσεις και τη μελέτη των επιπέδων έκφρασης των γονιδίων που ελέγχονται από αυτό.
ΕΝΔΕΙΚΤΙΚΕΣ ΠΗΓΕΣ
- Bacterial quorum sensing during infection, annualreviews.org. Διαθέσιμο εδώ
- Biofilm formation and inhibition mediated by bacterial quorum sensing, link.springer.com. Διαθέσιμο εδώ




