Της Μιχαέλας Βαλερά,
Όταν ήμασταν μικροί, μας ρωτούσαν ποιος ήταν ο μεγαλύτερός μας φόβος. Οι αράχνες, τα φίδια και οι μέλισσες ήταν μερικές από τις αυθόρμητες απαντήσεις μας, παραλείποντας πάντα τη μία και πιο σημαντική. Ο φόβος της απώλειας της ταυτότητας. Όταν παύεις να αναγνωρίζεις τα παιδιά σου, τους γονείς σου, τον σύντροφό σου, όταν παύεις να γνωρίζεις ποιος είσαι και προς τα που πορεύεσαι, είσαι τελικά αυτός που νόμιζες πως ήσουν; Πώς το μυαλό και η συνείδηση αποσυνδέθηκαν τόσο άχαρα από το σώμα, που για τόσα χρόνια υπέμενε όλη αυτήν την ατίθαση προσωπικότητα; Όταν ξεχνάς ποιος είσαι, ποιος είσαι τελικά; Περισσότερα από 50 εκατομμύρια άτομα παγκοσμίως βρίσκονται σε αυτήν τη δυσμενή θέση και πλέον η νόσος του Alzheimer θεωρείται η επιδημία του 21ου αιώνα.
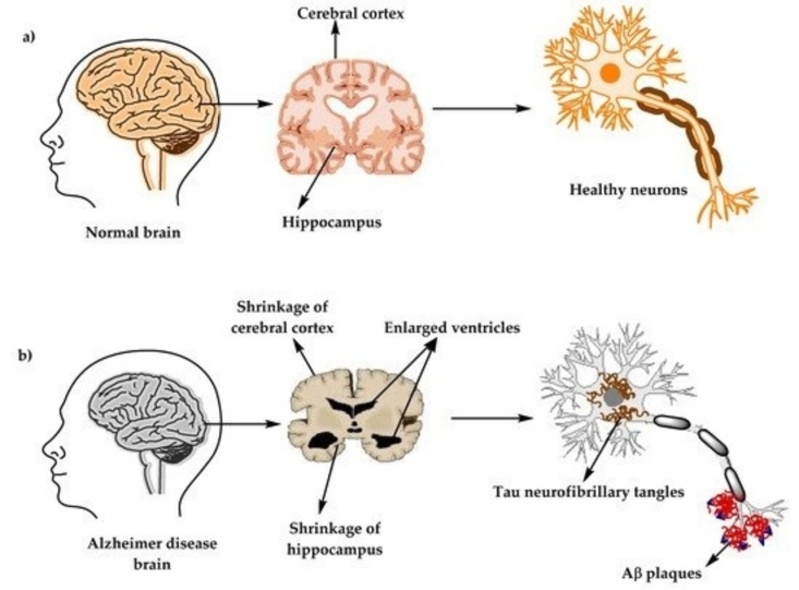
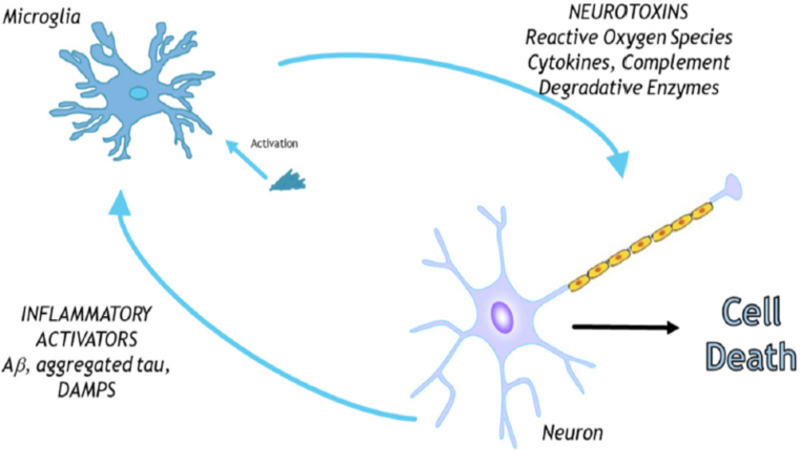
Η νόσος Alzheimer πλήττει ανήκεστα και όσο το προσδόκιμο ζωής αυξάνεται, τόσο οι συνέπειες γιγαντώνονται. Η παθογένεση της νόσου πυροδοτείται όταν πλάκες από μη σωστά αναδιπλωμένες πρωτεΐνες β-αμυλοειδούς επικάθονται στις νευρικές συνάψεις συνάμα με δεσμίδες πρωτεϊνών tau, οι οποίες διαδραματίζουν καίριο ρόλο στη σταθεροποίηση των μικροσωληνίσκων. Αυτές οι συσσωρεύσεις πρωτεϊνών στη συναπτική μετάδοση ενεργοποιούν την αμυντική πανοπλία του νευρικού συστήματος, τα κύτταρα της μικρογλοίας, τα οποία, αν και αποτυγχάνουν να επιτελέσουν αποτελεσματικά τη λειτουργία τους, απελευθερώνουν χημικούς μεταβολίτες που ενεργοποιούν τη χρόνια φλεγμονή. Το αποτέλεσμα; Ένας χρόνια φλεγμαίνων καβαλιστικός εγκέφαλος.
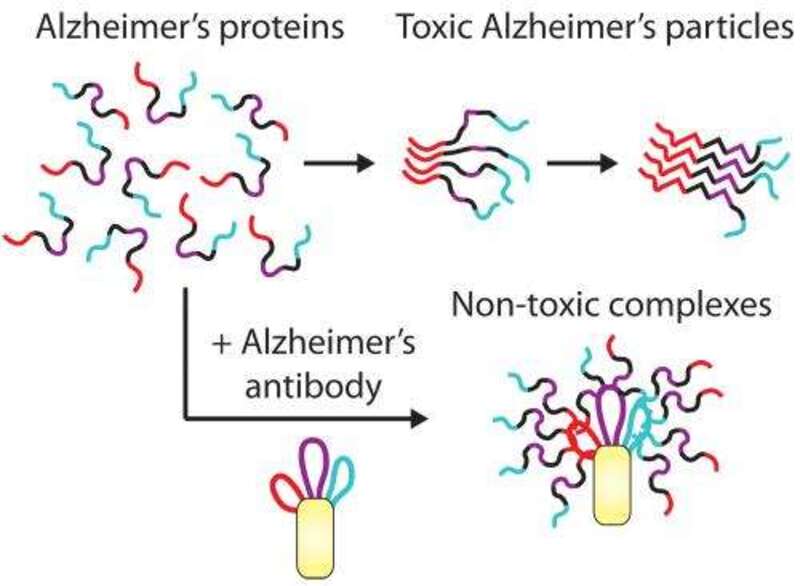
Αναστολείς χολινεστερασών, συμπληρώματα διατροφής, ανοσοθεραπείες και πολλά ακόμα έχουν προταθεί από την επιστημονική κοινότητα, χωρίς κανένα, όμως, να μπορεί να εξολοθρεύσει αυτές τις επίμονες συσσωρευμένες πλάκες. Κυματοθραύστης, όμως, αναδείχθηκε ένα καινοτόμο φάρμακο, γνωστό ως Lecanemab, σε ασθενείς με πρώιμα στάδια της νόσου. Η συγκεκριμένη θεραπεία αποτελεί ένα μονοκλωνικό αντίσωμα IgG1 που συνδέεται με υψηλή συγγένεια με τις διαλυτές πλάκες αμυλοειδούς. Παρά το πόσο ενθαρρυντικά ήταν τα ποσοστά επιβράδυνσης της νόσου, η κοστολόγηση παραμένει απρόσιτη και οι παρενέργειες θορυβώδεις. Γι’ αυτόν τον λόγο, οι επιστήμονες προχώρησαν στην ανεύρεση συνδυαστικών θεραπειών, που θα στοχεύουν τόσο στις πλάκες αμυλοειδούς όσο και στις πρωτεΐνες tau.
Το Tau NexGen είναι η πρώτη, και μέχρι στιγμής η μοναδική, εν εξελίξει κλινική δοκιμή συνδυαστικής θεραπείας για την πάθηση. Στις κλινικές μελέτες θα συμπεριληφθούν άτομα με λίγα ή καθόλου ανιχνεύσιμα συμπτώματα και θα χωριστούν σε επιμέρους ομάδες που θα λάβουν anti-tau θεραπεία (αντίσωμα έναντι της πρωτεΐνης tau) συνδυαστικά ή μη με το Lecanemab και το εικονικό φάρμακο. Στόχος είναι η θεραπεία anti-tau να ενισχύσει τα μέτρια οφέλη του lecanemab. Αν, όμως, η προσδοκία αυτή εκπληρωθεί, πόσο σίγουροι είμαστε πως όλοι οι ασθενείς θα έχουν την οικονομική δυνατότητα να εξασφαλίσουν τη σωτήρια, κατά τ’ άλλα, αγωγή τους, που μπορεί να υπερβαίνει τις € 30.000;
Επαναστατική ιδέα αποτέλεσε και η εξής: η ενίσχυση των ανοσολογικών υπερασπιστών του εγκεφάλου, δηλαδή της μικρογλοίας. Είναι γνωστό ότι μεταλλάξεις στο γονίδιο TREM2 που εκφράζουν τα κύτταρα της μικρογλοίας είναι υπεύθυνες για τη μείωση της λειτουργικότητάς τους και άρα ανεπαρκής καταπολέμηση των τόσο επίμονων πλακών αμυλοειδούς. Στο Πανεπιστήμιο Ludwig Maximilian του Μονάχου στη Γερμανία η υπόθεση αυτή γίνεται πραγματικότητα, δοκιμάζοντας σε ποντίκια πώς μπορεί να λειτουργήσει ένα αντίσωμα που δεσμεύει το TREM2 και ενεργοποιεί τη μικρογλοία εάν ληφθεί παράλληλα με θεραπεία αντι-αμυλοειδούς, ελπίζοντας πως το μέλλον δεν μοιάζει τόσο πομφολυγώδες όσο μπορεί να ακούγεται.
Πρωτοφανής ανακάλυψη ήταν και η συσχέτιση του γονιδίου APOE, το οποίο κωδικοποιεί μια πρωτεΐνη που εμπλέκεται στον μεταβολισμό του λίπους, με την εμφάνιση του Alzheimer. Επομένως, οι επιστήμονες επικεντρώθηκαν για ακόμα μία φορά στα οφέλη της γονιδιακής θεραπείας, αφού εντόπισαν ότι το αλληλόμορφο APOE4 συνδέεται με αυξημένο κίνδυνο εμφάνισης, ενώ το αλληλόμορφο APOE2 με μειωμένο. Έτσι, προσάρτησαν το γονίδιο APOE2 σε έναν ιικό φορέα και έκαναν ένεση απευθείας στο νωτιαίο υγρό των ασθενών. Παρόλη την εφευρετικότητα της μεθόδου, η γονιδιακή θεραπεία παρέλκει, καθώς και ένα μικρό ποσοστό των περιπτώσεων Alzheimer οφείλονται σε μεταλλάξεις του συγκεκριμένου γονιδίου.
Μελέτες του επίκουρου καθηγητή παθολογίας του Stanford Medicine, Siddhartha Jaiswal, ίσως να είναι, τελικά, το κλειδί της θεραπείας. Η ερευνητική ομάδα του καθηγητή διαπίστωσε πως μια κοινή πάθηση του αίματος, η κλωνική αιμοποίηση απροσδιόριστου δυναμικού ή CHIP (Clonal Hematopoiesis of Indeterminate Potential), σχετιζόταν με 30% έως 50% χαμηλότερο κίνδυνο εμφάνισης της νευροεκφυλιστικής νόσου. Πώς συμβαίνει αυτό; Το πιο πιθανό σενάριο είναι ότι ορισμένα βλαστικά κύτταρα του αίματος αποκτούν μεταλλάξεις, που ενισχύουν την ικανότητά τους να επιβιώνουν και να πολλαπλασιάζονται. Ως αποτέλεσμα, τα μεταλλαγμένα κύτταρα κυριαρχούν και λίγα μόνο κύτταρα μπορούν να δώσουν το μεγαλύτερο μέρος ή ακόμα και όλα τα κύτταρα του αίματος και του ανοσοποιητικού συστήματος του σώματος. Στις περισσότερες περιπτώσεις CHIP, ένα κυρίαρχο βλαστικό κύτταρο του αίματος δημιουργεί μεταξύ 4% και 30% των κυττάρων του αίματος και του ανοσοποιητικού συστήματος.
Μέχρι σήμερα, γνωρίζαμε πως τα αιμοσφαίρια αδυνατούσαν να εισέλθουν στον εγκέφαλο, λόγω της παρουσίας του αιματοεγκεφαλικού φραγμού – ασπίδα. Εντούτοις, ο Jaiswal παρατήρησε σε δείγματα εγκεφάλου ασθενών με CHIP την παρουσία αυτών των μεταλλαγμένων βλαστικών κυττάρων. Σαν να μην έφτανε αυτό, οι μεταλλάξεις αυτές εντοπίστηκαν και στα κύτταρα της μικρόγλοιας. Ειδικά όταν ανακάλυψαν πως η αναλογία των μεταλλαγμένων μικρογλοιακών κυττάρων σε κάθε μεμονωμένο εγκέφαλο έτεινε να ταιριάζει με την αναλογία των μεταλλαγμένων αιμοσφαιρίων στο υπόλοιπο σώμα, όσα γνώριζαν με σιγουριά τη δεδομένη στιγμή έμοιαζαν να καταρρέουν. «Αυτό υποδηλώνει ότι τα κύτταρα μεταναστεύουν από το αίμα στον εγκέφαλο», δήλωσε ο Jaiswal, προσθέτοντας ότι το εύρημα έρχεται σε αντίθεση με το αποδεκτό δόγμα. «Μια υπόθεση είναι ότι οι μεταλλάξεις που προάγουν ένα αναπτυξιακό πλεονέκτημα στα βλαστικά κύτταρα του αίματος προάγουν, επίσης, την επέκταση και τη δραστηριότητα των μικρογλοιακών κυττάρων, ενισχύοντας την ικανότητα των μικρογλοιακών κυττάρων να καταπολεμούν τις συνθήκες που οδηγούν σε εγκεφαλική νόσο», δηλώνει ο Jaiswal. Τα συμπεράσματα του καθηγητή είναι σαφώς ευρηματικά και σίγουρα κρατούν τα ηνία μιας νέας γενιάς θεραπευτικών δοκιμών.
Ύστερα από πλειάδα αποτυχημένων προσπαθειών, οι επιστήμονες έχουν πλέον αξιοσημείωτες πληροφορίες, που μπορούν να καθοδηγήσουν επιτυχημένα αυτήν τη φορά την πορεία των εκφυλιστικών παθήσεων και, πρωτίστως, τις ζωές εκατομμυρίων ανθρώπων. Όσο οι ρυθμοί επιταχύνονται και η τεχνολογία δυναστεύει, η επιστήμη οφείλει να εξελίσσεται παράλληλα και πάντα να χρησιμεύει ως αρωγός. Η νόσος του Alzheimer αποτελεί μια ακόμα πρόκληση και παρόλο που ακόμη έχουμε πολλά βήματα να διανύσουμε, κατευθυνόμαστε προς το σωστό μονοπάτι.
ΕΝΔΕΙΚΤΙΚΕΣ ΠΗΓΕΣ
- What happens to the brain in Alzheimer’s disease?, nia.nih.gov. Διαθέσιμο εδώ
- Three promising drugs for treating alzheimers disease bring fresh hope, biopharma-reporter.com. Διαθέσιμο εδώ
- Common blood condition may protect against alzheimer’s, futurity.org. Διαθέσιμο εδώ
- Alzheimer’s disease treatment, nhs.uk. Διαθέσιμο εδώ
- Conquering alzheimer’s: a look at the therapies of the future, nature.com. Διαθέσιμο εδώ
- Blood condition linked to protection against alzheimer’s, scopeblog.stanford.edu. Διαθέσιμο εδώ