Της Ιωάννας Μέγα,
Η μυασθένεια Gravis ή βαριά μυασθένεια είναι μια αυτοάνοση νόσος που χαρακτηρίζεται από δυσλειτουργία της νευρομυϊκής σύνδεσης και συνοδεύεται από αδυναμία και γρήγορη κόπωση οποιουδήποτε μυός βρίσκονται υπό τον εκούσιο έλεγχο μας (σκελετικοί μύες). Προκαλείται από διακοπή της φυσιολογικής επικοινωνίας μεταξύ νεύρων και μυών. Αν και η συγκεκριμένη ασθένεια μπορεί να προσβάλλει άτομα οποιασδήποτε ηλικίας, είναι πιο συχνή σε γυναίκες κάτω των 40 ετών και σε άνδρες άνω των 60 ετών. Η μυϊκή αδυναμία που προκαλείται από την μυασθένεια Gravis επιδεινώνεται, καθώς χρησιμοποιείται ο προσβεβλημένος μυς. Τα συμπτώματα συνήθως βελτιώνονται με την ανάπαυση, ωστόσο, τείνουν να εξελίσσονται με την πάροδο του χρόνου.
Συμπτωματολογία της νόσου
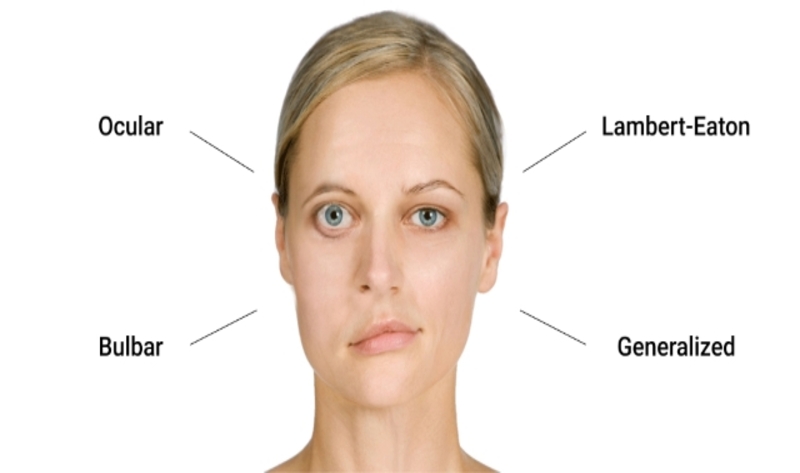
Αν και η μυασθένεια Gravis μπορεί να επηρεάσει οποιουσδήποτε από τους μύες ελέγχονται εκούσια, ορισμένες μυϊκές ομάδες επηρεάζονται συχνότερα από άλλες. Παρακάτω αναφέρονται οι πιο συχνά προσβεβλημένες μυϊκές ομάδες:
- Μύες των ματιών (πτώση του ενός ή και των δύο βλεφάρων, διπλή όραση «διπλωπία»)
- Μύες του προσώπου και του λαιμού (βλάβη στην ομιλία, δυσκολία στη μάσηση και την κατάποση, αλλαγές στις εκφράσεις του προσώπου)
- Μύες του λαιμού και των άκρων (η αδυναμία στα πόδια επηρεάζει τον τρόπο βάδισης, οι αδύναμοι μύες του λαιμού δυσκολεύουν τη στήριξη της κεφαλής).
Πηγή Εικόνας: lonestarneurology.ne
Τι προκαλεί, όμως, τη μυασθένεια Gravis;
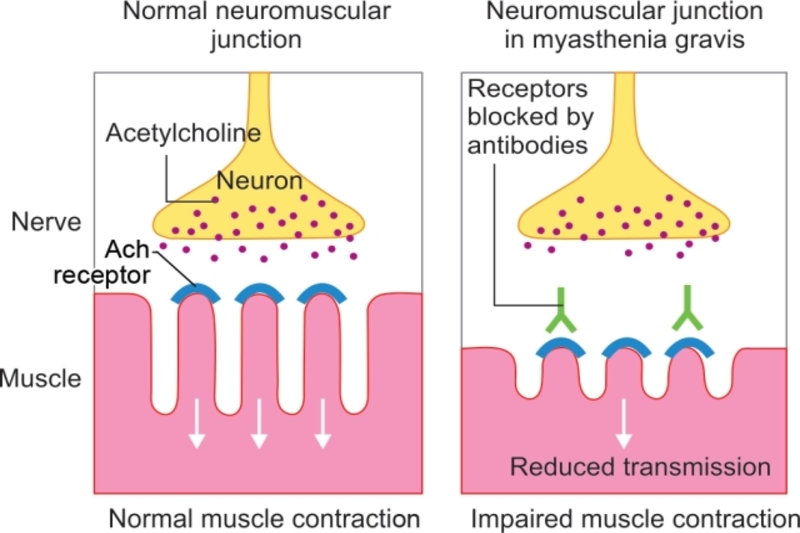
Φυσιολογικά, τα νεύρα μας επικοινωνούν με τους μύες μας μέσω νευρομυϊκών συνάψεων, απελευθερώνοντας χημικές ουσίες (νευροδιαβιβαστές), που ταιριάζουν με ακρίβεια στις θέσεις των υποδοχέων στα μυϊκά κύτταρα στη διασταύρωση νεύρου-μυών. Ωστόσο, στη μυασθένεια Gravis, το ανοσοποιητικό μας σύστημα παράγει αντισώματα που μπλοκάρουν ή καταστρέφουν πολλές από τις θέσεις των υποδοχέων των μυών για έναν νευροδιαβιβαστή, που ονομάζεται ακετυλοχολίνη. Με λιγότερες διαθέσιμες τοποθεσίες υποδοχέα, οι μύες σας λαμβάνουν λιγότερα νευρικά σήματα, με αποτέλεσμα την αδυναμία.
Τα αντισώματα αυτά εμποδίζουν, επίσης, και τη λειτουργία μιας πρωτεΐνης που ονομάζεται κινάση τυροσίνης ειδικού υποδοχέα μυών, που μερικές φορές αναφέρεται ως MuSK. Αυτή η πρωτεΐνη εμπλέκεται στο σχηματισμό της σύνδεσης νεύρου-μυών. Τα αντισώματα εναντίον αυτής της πρωτεΐνης μπορεί να οδηγήσουν σε μυασθένεια Gravis. Επιπλέον, τα αντισώματα έναντι μιας άλλης πρωτεΐνης, που ονομάζεται πρωτεΐνη 4 που σχετίζεται με τη λιποπρωτεΐνη (LRP4), μπορούν να παίξουν ρόλο στην ανάπτυξη αυτής της κατάστασης. Μερικοί άνθρωποι έχουν μυασθένεια Gravis που δεν προκαλείται από αντισώματα που μπλοκάρουν την ακετυλοχολίνη, το MuSK ή το LRP4. Αυτός ο τύπος μυασθένειας gravis ονομάζεται οροαρνητική μυασθένεια Gravis ή αρνητική σε αντίσωμα μυασθένεια gravis. Γενικά, οι ερευνητές υποθέτουν ότι αυτοί οι τύποι μυασθένειας Gravis εξακολουθούν να έχουν αυτοάνοση βάση, αλλά τα αντισώματα, που εμπλέκονται δεν είναι ακόμη ανιχνεύσιμα.
Ποιος ο ρόλος του θύμου αδένα στην παραγωγή αυτών των αντισωμάτων;
Ο θύμος αδένας είναι ένα μέρος του ανοσοποιητικού μας συστήματος. Ανατομικά βρίσκεται στο πάνω μέρος του θώρακα πίσω από το στέρνο μας. Οι ερευνητές πιστεύουν ότι ο θύμος αδένας πυροδοτεί ή διατηρεί την παραγωγή των αντισωμάτων που μπλοκάρουν την ακετυλοχολίνη. Ο θύμος αδένας, φυσιολογικά, είναι μεγάλος σε μέγεθος κατά την βρεφική ηλικία και μικρός κατά την ενήλικη ζωή. Παρόλα αυτά, σε ορισμένους ενήλικες με μυασθένεια Gravis ο θύμος αδένας είναι αφύσικα μεγάλος. Επιπλέον, είναι γνωστό ότι μερικοί άνθρωποι με μυασθένεια Gravis έχουν επίσης όγκους του θύμου αδένα (θυμώματα). Τα θυμώματα αυτά δεν είναι καρκινικά (κακοήθη), αλλά μπορεί να μεταπέσουν σε καρκινικά.
Διάγνωση
Ύστερα από ενδελεχή λήψη ιστορικού και φυσική εξέταση από τον εκάστοτε θεράποντα ιατρό (νευρολόγο), καθώς επίσης και κάποιες άλλες ειδικές διαγνωστικές μεθόδους, οι οποίες θα αναφερθούν παρακάτω, διεξάγεται η διάγνωση της συγκεκριμένης νόσου. Γενικότερα, η νευρολογική εξέταση (αντανακλαστικά, μυϊκή δύναμη, μυϊκός τόνος, αισθήσεις όρασης και αφής, συντονισμός, ισορροπία), οι εξετάσεις αίματος (ανίχνευση μη φυσιολογικών αντισωμάτων), και οι απεικονιστικές εξετάσεις (αξονική τομογραφία ή μαγνητική τομογραφία για έλεγχο του θύμου αδένα) είναι μεγίστης σημασίας όσον αφορά την διάγνωση της νόσου. Επιπλέον, υπάρχουν και χρησιμοποιούνται ευρέως, κάποιες βοηθητικές τεχνικές για την επιβεβαίωση της διάγνωσης. Τέτοιες τεχνικές είναι:
- Δοκιμή παγοκύστης (εφαρμόζεται σε πεσμένα βλέφαρα. Τοποθετείται μια σακούλα πάγου στο βλέφαρο. Μετά από λίγο, αφαιρείται και παρατηρείται το πεσμένο βλέφαρό για σημάδια βελτίωσης)
- Επαναλαμβανόμενη νευρική διέγερση (στέλνονται μικροί παλμοί ηλεκτρισμού μέσω ηλεκτροδίων για να μετρήσουν την ικανότητα του νεύρου να στέλνει σήμα στον μυ)
- Ηλεκτρομυογραφία μίας ίνας (EMG) (μετρά την ηλεκτρική δραστηριότητα που ταξιδεύει μεταξύ του εγκεφάλου και των μυών)
- Δοκιμές πνευμονικής λειτουργίας (αξιολογείται το κατά πόσο η μυασθένεια επηρεάζει την λειτουργία της αναπνοής).
Κυριότερες επιπλοκές που απορρέουν από την μυασθένεια Gravis
Οι επιπλοκές της μυασθένειας είναι θεραπεύσιμες, αλλά μερικές μπορεί να είναι απειλητικές για τη ζωή. Ορισμένες από αυτές αναφέρονται ενδεικτικά παρακάτω:
- Μυασθενική κρίση (οι μύες που ελέγχουν την αναπνοή γίνονται πολύ αδύναμοι για να λειτουργήσουν)
- Όγκοι θύμου αδένα (Οι περισσότεροι από αυτούς τους όγκους, που ονομάζονται θυμώματα, δεν είναι καρκινικοί).
Επιπλέον, έρευνες έχουν αποδείξει πως τα άτομα με μυασθένεια Gravis είναι πιο πιθανό να έχουν υπολειτουργικό ή υπερδραστήριο θυρεοειδή αδένα (εκκρίνει ορμόνες που ρυθμίζουν το μεταβολισμό). Επίσης, οι επιστήμονες θεωρούν πως τα άτομα με μυασθένεια gravis είναι πιο πιθανό να παρουσιάσουν αυτοάνοσες καταστάσεις, όπως η ρευματοειδής αρθρίτιδα και ο συστηματικός ερυθηματώδης λύκος.
Θεραπευτικές προσεγγίσεις
Όσον αφορά την μυασθένεια gravis η θεραπεία στοχεύει στην ανακούφιση σημείων και συμπτωμάτων, όπως αδυναμία των μυών των χεριών ή των ποδιών, διπλή όραση, πτώση των βλεφάρων και δυσκολίες στην ομιλία, τη μάσηση, την κατάποση και την αναπνοή. Η θεραπεία εξαρτάται από την ηλικία, τη σοβαρότητα της ασθένειας, καθώς επίσης και από την ταχύτητα εξέλιξής της.
Ορισμένες φαρμακευτικές παρεμβάσεις είναι:
- Αναστολείς χολινεστεράσης (ενισχύουν την επικοινωνία μεταξύ των νεύρων και των μυών)
- Κορτικοστεροειδή (αναστέλλουν το ανοσοποιητικό σύστημα περιορίζοντας την παραγωγή αντισωμάτων)
- Ανοσοκατασταλτικά (καταστέλλουν τη λειτουργία του ανοσοποιητικού συστήματος).
Ενδοφλέβιες θεραπείες αποτελούν:
- Πλασμαφαίρεση (διαδικασία φιλτραρίσματος παρόμοια με την αιμοκάθαρση)
- Ενδοφλέβια ανοσοσφαιρίνη (IVIg) (φυσιολογικά αντισώματα τα οποία αλλάζουν την απόκριση του ανοσοποιητικού σας συστήματος)
- Μονοκλωνικό αντίσωμα (Rituximab “Rituxan”, eculizumab “Soliris”).
Επιπλέον, όσον αφορά την θεραπεία η χειρουργική επέμβαση κρίνεται απαραίτητη σε ορισμένους ασθενείς με μυασθένεια Gravis, οι οποίοι έχουν όγκο στον θύμο αδένα. Η αφαίρεση του θύμου αδένα (θυμεκτομή) μπορεί να βελτιώσει τα συμπτώματα της μυασθένειας Gravis, ωστόσο, τα οφέλη της μπορεί να χρειαστούν χρόνια για να αποκαλυφθούν.
Είναι, όμως, αποτελεσματικές οι ήδη υπάρχουσες θεραπευτικές προσεγγίσεις;
Στην κλινική πράξη, τα κορτικοστεροειδή αποτελούν τον ακρογωνιαίο λίθο της θεραπείας, πέραν της συμπτωματικής φαρμακευτικής αγωγής, λόγω του χαμηλού κόστους, της ευρείας διαθεσιμότητάς τους, του σχετικά γρήγορου τρόπου δράσης και της εμπειρίας που αποκτήθηκε εδώ και δεκαετίες. Ωστόσο, η μακροχρόνια χρήση κορτικοστεροειδών εγκυμονεί σημαντικούς κινδύνους και σοβαρές ανεπιθύμητες παρενέργειες. Επιπλέον, τα μη στεροειδή ανοσοκατασταλτικά φάρμακα, που προστίθενται συνήθως στη θεραπεία, δυστυχώς, έχουν ένα αποτέλεσμα καθυστερημένης έναρξης και φαίνεται ότι είναι δύσκολο να αποκτηθούν στοιχεία για την αποτελεσματικότητά τους. Αρκετές δοκιμές που χρησιμοποιούν φάρμακα, που είχαν σαφή θετικά αποτελέσματα σε κλινικές δοκιμές για άλλες ανοσολογικές διαταραχές, όπως η ρευματοειδής αρθρίτιδα και ο συστηματικός ερυθηματώδης λύκος, απέτυχαν στη μυασθένεια Gravis. Αυτή η αποτυχία μπορεί εν μέρει να σχετίζεται με δυσκολίες στον σχεδιασμό της κλινικής δοκιμής για τη μυασθένεια, η οποία σαν νόσος έχει κυμαινόμενη πορεία και πιθανότατα είναι δύσκολο να εκτιμηθεί ποσοτικά.
Συνοψίζοντας, η αντιμετώπιση της μυασθένειας Gravis μπορεί να είναι δύσκολη, ωστόσο, νέες θεραπευτικές παρεμβάσεις στοχεύουν στην αποδυνάμωση της αυτοάνοσης απόκρισης, στην ενίσχυση της νευρομυϊκής σύναψης ή σε συνδυασμό και των δύο στρατηγικών. Η αύξηση της γνώσης σχετικά με τους παθοφυσιολογικούς μηχανισμούς, που διαμεσολαβούνται μπορεί να βοηθήσει στη βελτίωση της θεραπείας των ατόμων με μυασθένεια Gravis και να οδηγήσει στην ανάπτυξη πιο εξατομικευμένων θεραπευτικών προσεγγίσεων.
ΕΝΔΕΙΚΤΙΚΕΣ ΠΗΓΕΣ
- Myasthenia gravis – Symptoms and causes, Mayo Clinic. Διαθέσιμο εδώ
- Myasthenia gravis – Diagnosis and treatment, Mayo Clinic. Διαθέσιμο εδώ
- Emerging therapies for autoimmune myasthenia gravis: Towards treatment without corticosteroids, Science Direct. Διαθέσιμο εδώ
- Advances and challenges in the treatment of myasthenia gravis, PubMed. Διαθέσιμο εδώ
- Novel Treatments in Myasthenia Gravis, PubMed. Διαθέσιμο εδώ