Του Εμμανουήλ Μπιμπή,
Τα χλαμύδια αποτελούν ένα από τα γνωστότερα βακτηριακής προέλευσης σεξουαλικώς μεταδιδόμενο νόσημα και προκαλείται από το κατά gram αρνητικό Chlamydia trachomatis βακτήριο με σχεδόν 127 εκατομμύρια καταγεγραμμένες μολύνσεις το 2016. Το βακτήριο αυτό χαρακτηρίζεται ως υποχρεωτικά ενδοκυττάριο, ενώ διακρίνεται σε επιμέρους στελέχη με διαφορετικές αντιγονικές ιδιότητες, ιδιαίτερα σε υπομονάδες της κύριας πρωτεΐνης στην εξωκυτταρική μεμβράνη του βακτηρίου.
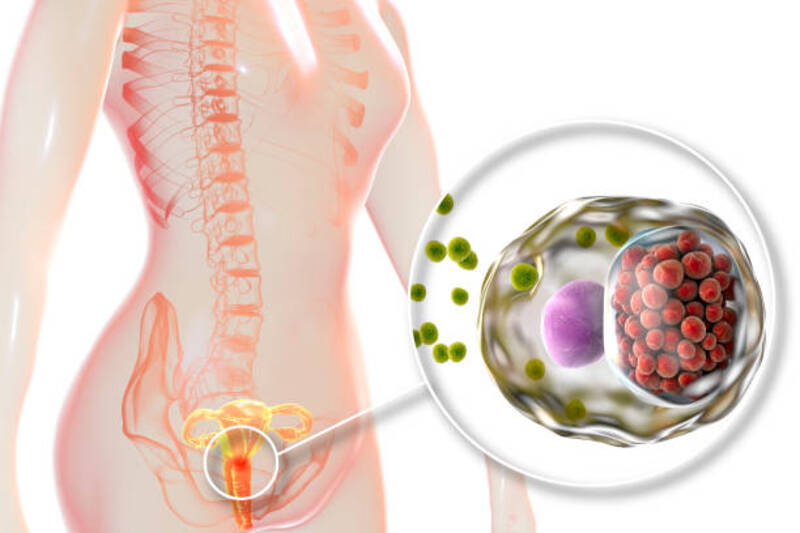
Εκτός από μολύνσεις στο γεννητικό σύστημα, το βακτήριο μπορεί να προκαλέσει τύφλωση, οπτικές διαταραχές, μολύνσεις στους άντρες στην ουρήθρα και στην επιδιδυμίδα. Στις γυναίκες προκαλεί φλεγμονώδη νόσο της πυέλου, που έχει σχετιστεί με υπογεννητικότητα, εκτοπική εμφύτευση του αναπτυσσόμενου εμβρύου και χρόνιο πυελικό πόνο.
Η αντιμετώπιση των σεξουαλικώς μεταδιδόμενων μολύνσεων γίνεται κυρίως με το αντιβιοτικό αζιθρομυκίνη που, όμως, περιορίζεται σε αυτούς που από μόνοι τους αναζητούν έλεγχο και θεραπεία χωρίς να υπάρχουν προγράμματα μαζικού ελέγχου. Για τη μόλυνση του επιπεφυκότα, γνωστή και ως τράχωμα ή κοκκώδης επιπεφυκίτιδα, έχουν πραγματοποιηθεί προγράμματα χρήσης αντιβιοτικών για την εξάλειψή της. Παρόλα αυτά, υπάρχουν περιοχές που έχουν ενδημικό χαρακτήρα. Σε αυτό συμβάλλει το γεγονός πως το 80% των μολύνσεων είναι ασυμπτωματικές και άρα, περιοχές όπου δεν υπάρχουν μεγάλες καμπάνιες ελέγχου και θεραπείας, τα επίπεδα των μολύνσεων και μετάδοσης παραμένουν υψηλά.
Δεδομένου ότι μια μόλυνση με αυτό το βακτήριο μπορεί να είναι από ασυπτωματική έως αρκετά σοβαρή με επιπλοκές, οφείλεται στις ιδιαιτερότητες της ανοσολογικής απόκρισης του κάθε ασθενή και στην παθογονικότητα του συγκεκριμένου στελέχους. Έχοντας υπόψιν αυτό, καθώς και τους περιορισμούς στον έλεγχο και τη θεραπεία, έχουν γίνει πολλές προσπάθειες ανάπτυξης αποτελεσματικού εμβολίου. Όμως, το γεγονός αυτό εμφανίζει δυσκολίες που αφορούν τις προσαρμογές του βακτηρίου τις οποίες κατέχει, για να αποφύγει το ανοσοποιητικό σύστημα του ασθενούς.
Ο κύκλος ζωής του βακτηρίου χαρακτηρίζεται ως διφασικός αποτελούμενος από δυο μορφολογικά διαφορετικές μορφές, το εξωκυττάριο στοιχειώδες σώμα (elementary body, EB) και το ενδοκυττάριο δικτυωτό σώμα (reticular body, RB). Το βακτήριο στην EB μορφή μεταδίδεται από άτομο σε άτομο και μόλις έρθει σε επαφή με τα επιθηλιακά κύτταρα του ξενιστή χρησιμοποιεί διάφορα «όπλα» για να εισέλθει σε αυτά. Μόλις τα βακτήρια εισέλθουν, μετατρέπονται στην RB μορφή εντός ενός παρασιτικού θυλακίου (vacuole) και ανάλογα με τη διαθεσιμότητα θρεπτικών κυττάρων υπάρχουν δύο επιλογές. Τα βακτήρια αξιοποιούν αυτά τα θρεπτικά κύτταρα για τον πολλαπλασιασμό τους, τη διαφοροποίηση πάλι στην EB μορφή και την έξοδο από το κύτταρο, με συνηθέστερο αποτέλεσμα τη λύση του είτε παραμένουν εντός του κυττάρου σε αδρανή κατάσταση.
Ως υποχρεωτικά ενδοκυτταρικό μικρόβιο, η EB μορφή του βακτηρίου είναι μεταβολικά ανενεργή και με προσαρμογές για την εξωκυττάριο επιβίωση, την προσκόλληση στα κύτταρα του ξενιστή και την είσοδο σε αυτά. Ενδιαφέρον προκαλεί το γεγονός ότι ένα σημαντικό στοιχείο, η δομική στήριξη του βακτηρίου, δεν προέρχεται από την πεπτιδογλυκάνη, αλλά από ένα δίκτυο πρωτεϊνών της εξωκυττάριας μεμβράνης (Omp) συνδεδεμένων με δισουλφιδικούς δεσμούς. Το TSS3 εκκριτικό σύστημα ξεπροβάλλει μέσα από το πρωτεϊνικό πλέγμα και παίζει σημαντικό ρόλο στην προσκόλληση, είσοδο και στην έπειτα έκκριση δραστικών παραγόντων.
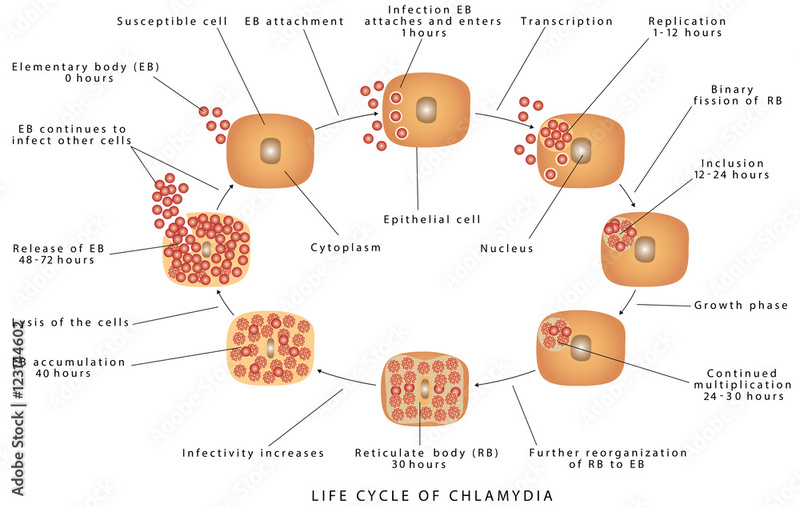
Η διαδικασία της προσκόλλησης αποτελείται από ένα πρώτο αντιστρεπτό βήμα και ένα δεύτερο μη αναστρεπτό. Στο πρώτο βήμα παρατηρούνται χαμηλής συγγένειας ηλεκτροστατικές αλληλεπιδράσεις μεταξύ επιφανειακών πρωτεϊνών των ΕΒ και γλυκοσαμινών στην επιφάνεια των κυττάρων. Στο δεύτερο βήμα, παρατηρείται υψηλής συγγένειας σύνδεσης υποδοχέων στην επιφάνεια των κυττάρων στον LPS (λιποπολυσακχαρίτη) ή στον υποδοχέα μαννόζης των κυττάρων. Η σύνδεση αυτή επιτρέπει στο κύτταρο να απελευθερώσει στο εσωτερικό του κυττάρου παράγοντες που επηρεάζουν τη δομή της ακτίνης (στοιχείου του κυτταρικού σκελετού), με αποτέλεσμα την άμεση εγκόλπωση και εσωτερίκευση του.
Το θυλάκιο που σχηματίζεται δημιουργεί στο εσωτερικό του ένα μικροπεριβάλλον κατάλληλο για τον πολλαπλασιασμό του βακτηρίου, εφόσον αλλάξει στη μεταβολικά ενεργή RB μορφή, καθώς εκκρίνει παράγοντες που αποτρέπουν την καταστροφή του από τα λυσοσσώματα. Τα λυσοσσώματα είναι οργανίδια που, μεταξύ άλλων, είναι υπεύθυνα για την καταστροφή των ξένων εισβαλλόντων στοιχείων και, ταυτόχρονα, προσελκύουν θυλάκια του κυττάρου που περιέχουν θρεπτικά συστατικά, όπως χοληστερόλη και φωσφατίδυλοχολίνη (κοινό μεμβρανικό φωσφολιπίδιο). Όπως αναφέρθηκε και παραπάνω, η έλλειψη θρεπτικών αντιβιοτικών, αλλά και η ύπαρξη κάποιων κυτοκινών σε χαμηλές συγκεντρώσεις οδηγεί σε παραμονή του βακτηρίου σε αδρανή μορφή εντός των κυττάρων in vitro.
Μόλις οι φυσιολογικές συνθήκες επανέλθουν, ακολουθούν πολλές και γρήγορες κυτταρικές διαιρέσεις μέχρι τη μετάβαση πίσω στην ΕΒ μορφή για την έξοδο από το κύτταρο. Ο μηχανισμός της μετάβασης είναι άγνωστος και φαίνεται να μην γίνεται συγχρονισμένα για όλα τα κύτταρα. Δεδομένα ηλεκτρονικής μικροσκοπίας δείχνουν πως καθοριστικός παράγοντας είναι το μέγεθος του RB κυττάρου, συνοδευόμενο από αλλαγή στα πρότυπα γονιδιακής έκφρασής. Η απελευθέρωση από το κύτταρο μπορεί να γίνει είτε με άμεση λύση του κυττάρου είτε με απλή λύση του θυλακίου λόγω σύντηξής του με τη μεμβράνη του κυττάρου. Αυτό αφήνει τη μεμβράνη ανέπαφη και το βακτήριο διατηρεί και τη δική του μεμβράνη.
Ο συγκεκριμένος κύκλος ζωής του βακτηρίου επηρεάζει την αναγνώρισή του από το ανοσοποιητικό σύστημα με τους εξής τρόπους. Αρχικά, ο LPS των ΕΒ βρίσκεται σε λιγότερη ποσότητα και είναι δομικά διαφορετικός, με αποτέλεσμα να προκαλεί μειωμένη ανοσολογική απόκριση. Παράλληλα, όταν βρίσκεται στο εσωτερικό των επιθηλιακών κυττάρων, παράγει κατάλληλους παράγοντες, οι οποίοι εμποδίζουν την παραγωγή προστατευτικών φλεγμονωδών παραγόντων, με αποτέλεσμα τη μειωμένη ανοσολογική απόκριση. Επιπλέον, το βακτήριο εμποδίζει την απόπτωση του κυττάρου και συνολικά επηρεάζει τα σήματα που δέχεται, ώστε να δημιουργήσει το κατάλληλο περιβάλλον για τον ενδοκυττάριο πολλαπλασιασμό του.
Συνοψίζοντας, η σε μεγαλύτερο βάθος κατανόηση της αλληλεπίδρασης του βακτηρίου με το ανοσοποιητικό σύστημα θα μας βοηθήσει στην ανάπτυξη ενός αποτελεσματικότερου εμβολίου. Ταυτόχρονα, επιτακτική θεωρείται η ανάγκη παρακολούθησης σε διεθνές επίπεδο και ο μαζικός έλεγχος, ώστε να περιοριστεί η διασπορά του, ιδιαίτερα στις αναπτυσσόμενες χώρες.
ΕΝΔΕΙΚΤΙΚΕΣ ΠΗΓΕΣ
- Chlamydia trachomatis: Cell biology, immunology and vaccination, sciencedirect.com. Διαθέσιμο εδώ
- Chlamydia cell biology and pathogenesis. Nature Reviews Microbiology, nature.com. Διαθέσιμο εδώ